西農園藝學院DNA甲基化+組蛋白修飾綜合分析揭示蘋果干旱脅迫的表觀基因組調控機制|PBJ/IF10.5
近日,西北農林科技大學園藝學院徐記迪副教授、管清美教授和塔里木大學王江波副教授團隊合作,通過多組學分析揭示蘋果在干旱脅迫下的表觀基因組特征。研究綜合運用全基因組重亞硫酸鹽測序(Whole-Genome Bisulfite Sequencing, WGBS)、染色質免疫沉淀測序(Chromatin Immunoprecipitation Sequencing, ChIP-seq)和轉錄組測序(RNA-seq)技術的多組學整合分析,揭示了蘋果在干旱處理不同時間點(0天、3天、6天和9天)的DNA甲基化、組蛋白修飾和基因表達變化。研究發現,干旱脅迫下蘋果的基因表達、DNA甲基化和組蛋白修飾均發生顯著變化,并鑒定出兩個關鍵基因MdABI5和MdOCP3,其通過組蛋白修飾調控蘋果抗旱性。相關研究成果以《An integrative multi-omics analysis of histone modifications and DNA methylation reveals the epigenomic landscape in apple under drought stress》為題發表于《Plant Biotechnology Journal》(IF:10.5)期刊。

標題:An integrative multi-omics analysis of histone modifications and DNA methylation reveals the epigenomic landscape in apple under drought stress(組蛋白修飾和DNA甲基化的綜合多組學分析揭示了干旱脅迫下蘋果的表觀基因組譜)
發表時間:2025年07月07日
發表期刊:Plant Biotechnology Journal(PBJ)
影響因子:IF10.5/Q1
技術平臺:WGBS、ChIP-seq、RNA-seq
作者單位:西北農林科技大學園藝學院徐記迪、管清美等
doi: 10.1111/pbi.70173
表觀遺傳調控在植物發育和逆境響應過程中發揮著關鍵作用。先前研究表明表觀遺傳修飾參與蘋果干旱響應,但其干旱響應機制仍需要一個全面的表觀基因組學來表征。本研究在干旱處理后0天、3天、6天和9天時,對蘋果屬植物湖北海棠(Malus hupehensis)進行了轉錄組測序、DNA甲基化(WGBS)和六種組蛋白修飾(H3ac、H3K9ac、H3K14ac、H3K4me3、H3K27me3和H3K36me3)的ChIP-seq分析。研究結果揭示在干旱處理后6天的差異表達基因變化最為顯著。在干旱處理后3天基因區域周圍DNA甲基化水平達到最高。在干旱處理下,六種組蛋白修飾的整體富集水平略有下降。上調的干旱響應基因中,具有較高變化倍數(fold changes)基因與H3K27me3低水平修飾相關,而具有較低變化倍數的上調基因則與H3K4me3高水平修飾相關。許多干旱響應基因(如MYB88、NCED3和JAZ1)受表觀遺傳修飾調控。研究驗證了MdABI5(受H3K14ac和H3K27me3調控)和MdOCP3(受H3K9ac和H3K36me3調控)這兩個受多種表觀遺傳修飾調控的候選干旱響應基因的功能。轉基因蘋果在干旱條件下的表型顯示,MdABI5和MdOCP3正向調控蘋果的抗旱性。本研究結果為表觀遺傳修飾的分子機制研究提供了新見解,并為提高蘋果的抗旱性提供了理論依據。
研究方法
(1)植物材料與干旱處理:3月齡蘋果(Malus hupehensis)幼苗,種植于溫室中。干旱處理通過逐步減少土壤水分進行,分別在0天(A0d)、3天(A3d)、6天(A6d)和9天(A9d)取樣。取樣時,選取每株植物的第4-6片葉作為生物學重復樣本。
(2)轉錄組測序(RNA-seq):檢測基因表達水平。
(3)全基因組重亞硫酸鹽測序(WGBS):分析全基因組水平的DNA甲基化狀態。
(4)染色質免疫沉淀測序(ChIP-seq):分析H3ac、H3K9ac、H3K14ac、H3K4me3、H3K27me3和H3K36me3六種組蛋白修飾水平。
(5)轉基因植物構建與表型分析:將MdABI5和MdOCP3基因導入蘋果GL-3品種中,構建過表達和RNA干擾轉基因株系。通過PCR和RT-qPCR驗證轉基因株系,并在干旱條件下評估其表型和生理指標。
結果圖形
(1)不同干旱處理下蘋果的動態基因表達變化
研究通過轉錄組分析發現,在干旱處理3天(A3d)時,蘋果中有3041個差異表達基因(DEGs),表明許多基因在干旱早期就已經響應。隨著干旱時間延長,DEGs數量在6天(A6d)時達到峰值(3818個),9天(A9d)時略有下降(3816個)。基因表達趨勢的聚類分析顯示,大多數基因在A6d時表達量達到峰值,且與水分剝奪相關的基因在A6d時顯著富集。研究還發現一些基因(如TIFY10A-like、XTH33、RPM1-like和PK1)在干旱處理過程中表達量持續上調或下調,這些基因可能在干旱響應中發揮重要作用。通過對不同表達趨勢的基因組分析,結果表明其在缺水、激素響應、離子穩態和代謝過程等通路中顯著富集,表明A6d是蘋果干旱響應的關鍵階段。
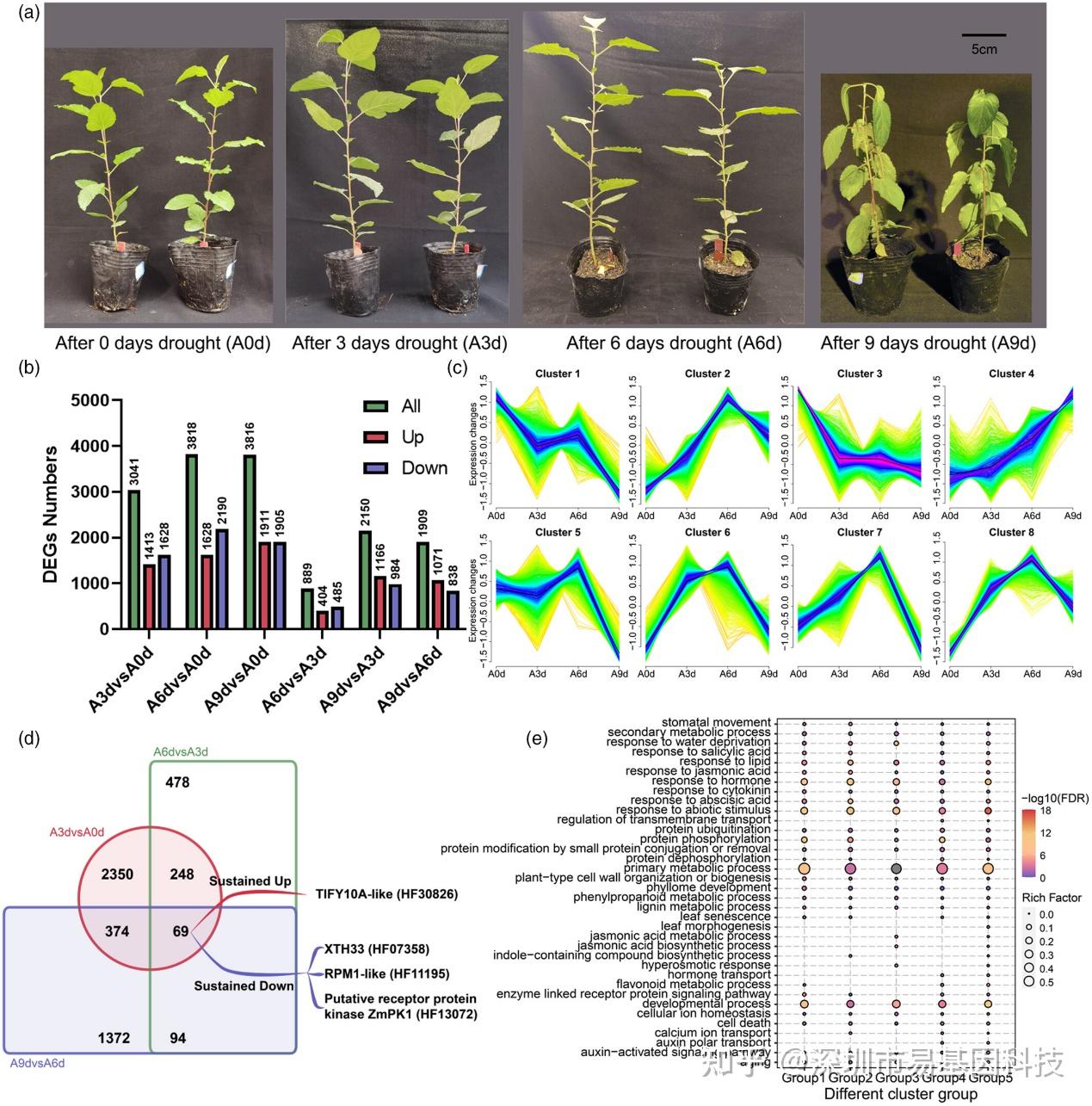
圖1:轉錄組差異分析、聚類和功能富集結果。
- 湖北海棠(Malus hupehensis)在干旱處理0天、3天、6天和9天時的表型。
- 不同差異比較組合時期中的差異表達基因(DEGs)數量。
- 不同時期DEGs表達趨勢的聚類分析。
- 干旱處理下相鄰比較組合中DEGs的重疊情況。
- 不同表達趨勢基因組的功能富集比較點圖(第1組:Cluster 1,第2組:Cluster 3,第3組:Cluster 4,第4組:Cluster 5,第5組:Cluster 2、6、7和8)。
(2)蘋果響應干旱脅迫的DNA甲基化圖譜
研究通過WGBS技術分析了蘋果在干旱處理下的DNA甲基化變化。結果顯示,在干旱處理早期(A3d),基因區域附近的DNA甲基化水平顯著增加,隨后在A6d略有下降,A9d時又略有回升。表明DNA甲基化在干旱脅迫的早期階段起著關鍵作用。研究還發現與對照組相比,干旱處理下蘋果的mCG、mCHG和mCHH三種DNA甲基化類型均顯著增加。此外研究分析了DNA甲基化與基因表達的相關性,發現差異甲基化區域(DMRs)與DEGs在A3d vs A0d、A6d vs A0d和A9d vs A3d的比較組中呈差異變化模式,這與DNA甲基化在啟動子區域的抑制效應一致。研究還分析了DNA甲基化在全基因組水平的分布,發現mCHH在基因上游2000bp區域內的增加可能與RNA介導的DNA甲基化(RdDM)通路激活有關,但24nt siRNA的富集并未顯著變化。這表明DNA甲基化水平變化可能受多種因子綜合調控。
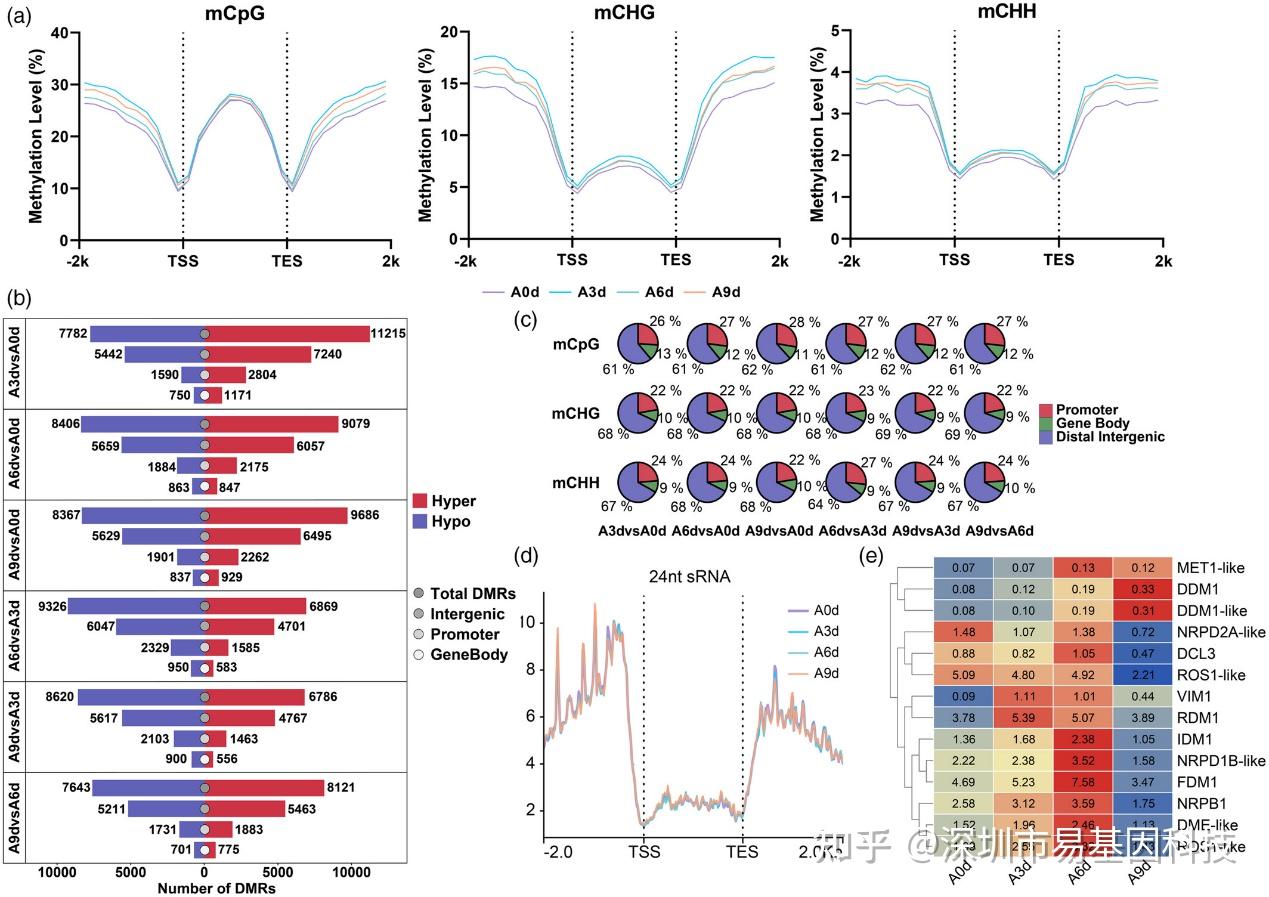
圖2:WGBS、24nt siRNA分布以及與甲基轉移酶變化對干旱響應的特征分析。
- 全基因組水平上genebody附近區域的DNA甲基化模式。
- 不同干旱比較組合下與高甲基化和低甲基化DMRs相關的基因數量。
- 不同比較組合在全基因組水平上每種甲基化類型分布的百分比。
- genebody區域附近24nt siRNA的富集情況。
- 在干旱處理下差異表達的DNA甲基化相關因子的表達模式。
(3)蘋果響應干旱脅迫的組蛋白修飾變化圖譜
研究通過ChIP-seq技術分析了六種組蛋白修飾(H3ac、H3K9ac、H3K14ac、H3K4me3、H3K27me3和H3K36me3)在干旱處理下的變化。結果顯示,這些組蛋白修飾在基因區域和啟動子區域的分布與基因表達調控密切相關。在干旱處理下,組蛋白修飾的整體水平略有下降,但某些基因區域修飾水平發生顯著變化。如與對照組相比,A6d時H3K4me3、H3K9ac和H3K14ac水平略有下降,而H3K27me3水平則顯著下降。研究還發現組蛋白修飾變化與基因表達變化之間存在一定相關性。如上調基因與H3K27me3低水平相關,而上調基因與H3K4me3高水平相關。這些結果表明,組蛋白修飾在蘋果響應干旱脅迫過程中發揮著重要的調控作用。
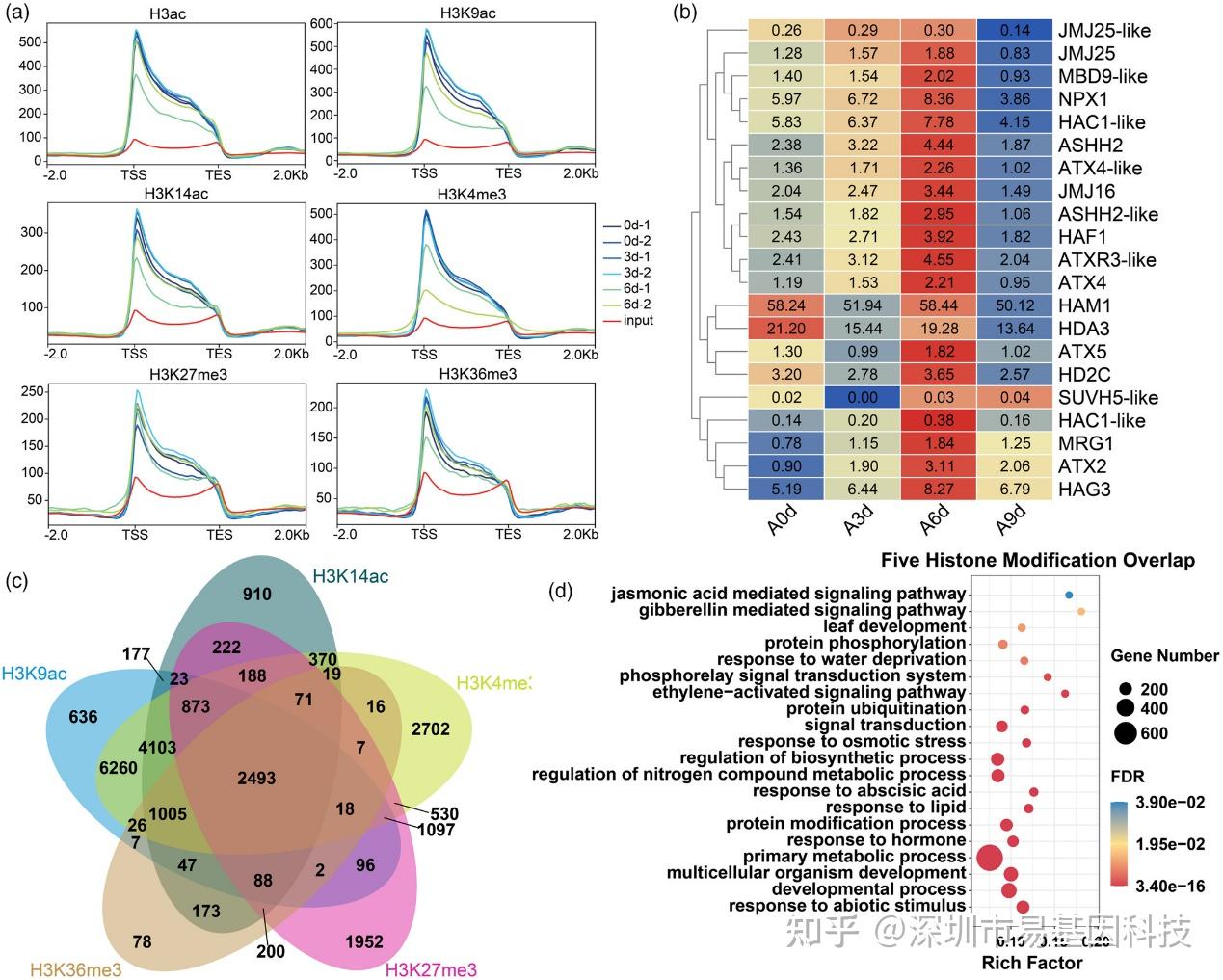
圖3:組蛋白修飾的特征分析及差異分析。
- 各種組蛋白修飾在基因區域周圍的分布情況。
- 在干旱處理下差異表達的組蛋白修飾相關因子的表達模式。
- 受組蛋白修飾調控的干旱響應基因的重疊情況。
- 干旱處理下組蛋白修飾富集偏好基因的功能分析。
(4)組蛋白修飾和DNA甲基化變化對干旱響應中基因表達變化的作用
研究分析了DNA甲基化和組蛋白修飾在干旱響應中的協同作用。結果顯示,雖然在全基因組水平上DNA甲基化與組蛋白修飾分布并無明顯協同效應,但在某些基因的轉錄調控中,兩種表觀遺傳修飾可能互作。例如,研究發現與對照組相比,A6d時有40.9%的DEGs受組蛋白修飾調控,其中H3K4me3調控基因數量最多。研究還發現,DNA甲基化和組蛋白修飾在調控基因表達方面存在一定偏好性。例如上調基因中,低倍數變化基因主要受H3K4me3調控,而高倍數變化基因則主要受H3K27me3低水平調控。這些結果表明,DNA甲基化和組蛋白修飾在蘋果干旱響應中通過復雜機制調控基因表達。
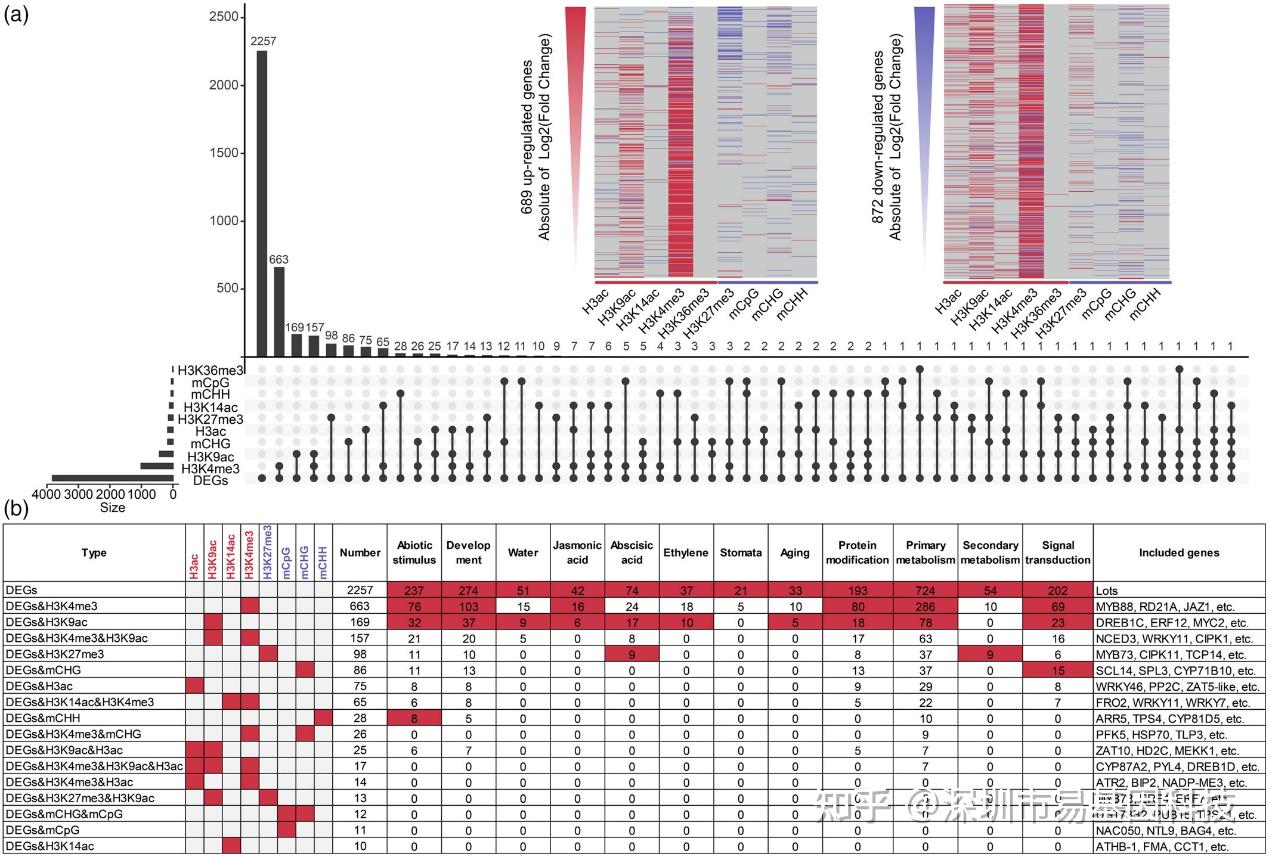
圖4:六種組蛋白修飾、DNA甲基化及其在干旱處理下的調控功能之間相關性。
- 由DNA甲基化和組蛋白修飾共同調控的差異表達基因以及這些調控基因表達變化的Upset圖。所有受表觀遺傳修飾調控的上調和下調DEGs與表觀遺傳修飾、log2(變化倍數)和組蛋白修飾之間的關系熱圖。紅色表示與表觀遺傳修飾呈正相關,而藍色表示負相關。
- 受不同表觀遺傳修飾調控的基因的功能富集表。紅色表示在GO通路中顯著富集,白色表示不顯著。
(5)組蛋白修飾調控的MdABI5正向調控蘋果抗旱性
研究發現,MdABI5基因在干旱脅迫下表達上調,且其上游的H3K14ac水平增加,H3K27me3水平降低。通過構建MdABI5過表達(MdABI5-OE)和RNA干擾(MdABI5-RNAi)轉基因植株,研究發現MdABI5正向調控蘋果抗旱性。在干旱條件下,MdABI5-OE植株表現出更高的存活率、更低的離子滲漏率和更高的相對含水量,表明其抗旱性增強。而MdABI5-RNAi植株表現出更高的離子滲漏率和更低的存活率,表明其抗旱性減弱。這些結果表明,MdABI5通過組蛋白修飾調控蘋果抗旱性。
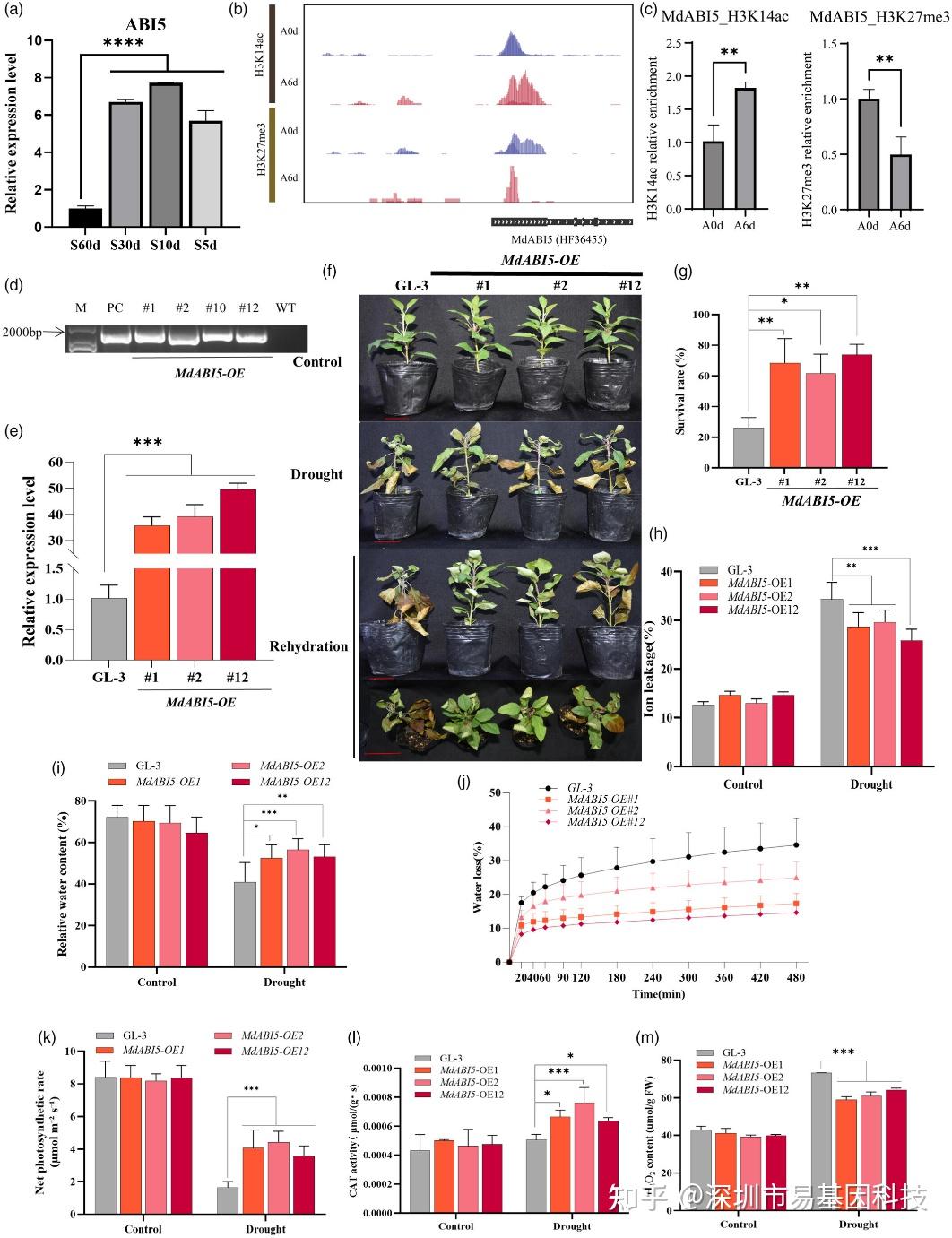
圖5:MdABI5過表達(MdABI5-OE)增強蘋果抗旱性。
- 湖北海棠(Malus hupehensis)在不同土壤含水量下干旱處理時MdABI5的表達情況。
- 干旱處理和對照條件下MdABI5上游H3K14ac和H3K27me3的基因組瀏覽器快照。
- ABI5上游組蛋白修飾的ChIP-qPCR驗證。
- 在DNA水平上鑒定MdABI5-OE轉基因植株。
- 在RNA水平上鑒定MdABI5-OE植株。
- GL-3(野生型)和MdABI5-OE轉基因植株的表型。
- 圖(f)中GL-3和三條獨立的MdABI5-OE株系存活率。
- GL-3和MdABI5-OE植株在干旱處理下的葉片離子滲漏測定。
- GL-3和MdABI5-OE植株在干旱下的葉片相對含水量(RWC)。
- GL-3和MdABI5-OE植株的離體葉片在25°C下的水分丟失。
- GL-3和MdABI5-OE植株在干旱處理下的光合速率分析。
- GL-3和MdABI5-OE植株在干旱處理下的過氧化氫酶(CAT)活性。
- GL-3和MdABI5-OE植株在干旱處理下的過氧化氫(H2O2)含量。

圖6:MdABI5的RNA干擾(MdABI5-RNAi)降低蘋果抗旱性。
- 在DNA水平上鑒定MdABI5-RNAi轉基因植株。
- 在RNA水平上鑒定MdABI5-RNAi植株。
- GL-3和MdABI5-RNAi轉基因植株的表型。
- 圖(c)中GL-3和兩條獨立的MdABI5-RNAi株系的存活率。
- GL-3和MdABI5-RNAi植株在干旱處理下的葉片離子滲漏測定。
- GL-3和MdABI5-RNAi植株在干旱下的葉片RWC。
- GL-3和MdABI5-RNAi植株的離體葉片在25°C下的水分丟失。
- GL-3和MdABI5-RNAi植株在干旱處理下的光合速率分析。
- GL-3和MdABI5-RNAi植株在干旱處理下的CAT活性。
- GL-3和MdABI5-RNAi植株在干旱處理下的H2O2含量。
(6)組蛋白修飾調控的MdOCP3正向調控蘋果抗旱性
研究發現,MdOCP3基因在干旱脅迫下表達下調,且其上游的H3K9ac和H3K36me3水平降低。通過構建MdOCP3過表達(MdOCP3-OE)和RNA干擾(MdOCP3-RNAi)轉基因株系,研究發現MdOCP3正向調控蘋果的抗旱性。在干旱條件下,MdOCP3-OE株系表現出更高的存活率、更低的離子滲漏率和更高的相對含水量,表明其抗旱性增強。相反,MdOCP3-RNAi株系則表現出更高的離子滲漏率和更低的存活率,表明其抗旱性減弱。這些結果表明,MdOCP3通過組蛋白修飾調控蘋果的抗旱性。
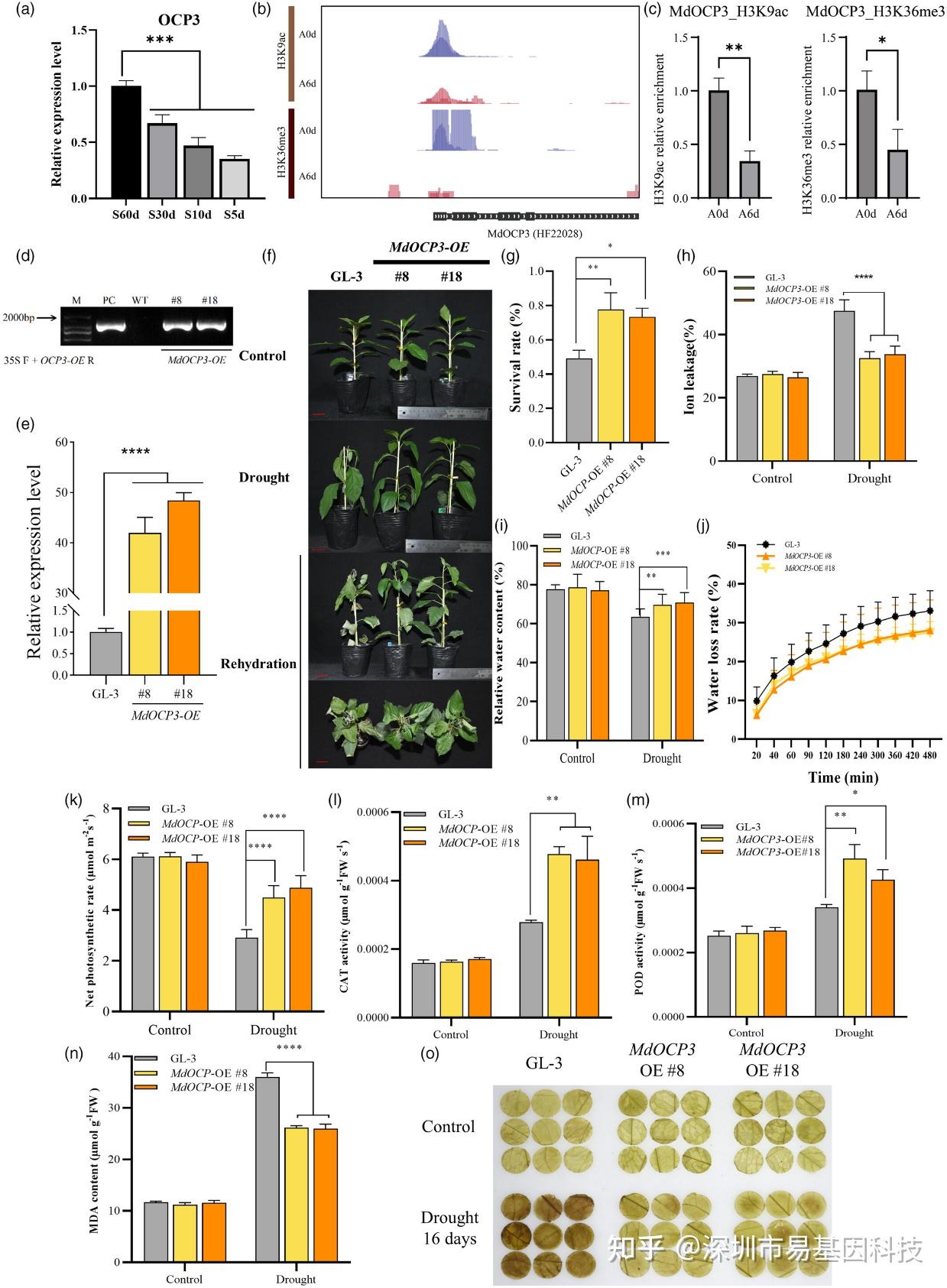
圖7:MdOCP3過表達(MdOCP3-OE)增強蘋果抗旱性。
- 湖北海棠(Malus hupehensis)在不同土壤含水量下干旱處理時MdOCP3的表達情況。
- 干旱處理和對照條件下MdOCP3上游H3K9ac和H3K36me3的基因組瀏覽器快照。
- OCP3上游組蛋白修飾的ChIP-qPCR驗證。
- 在DNA水平上鑒定MdOCP3-OE轉基因株系。
- 在RNA水平上鑒定MdOCP3-OE株系。
- GL-3和MdOCP3-OE轉基因植株的表型。
- 圖(f)中GL-3和兩條獨立的MdOCP3-OE株系的存活率。
- GL-3和MdOCP3-OE植株在干旱處理下的葉片離子滲漏測定。
- GL-3和MdOCP3-OE植株在干旱下的葉片相對含水量(RWC)。
- GL-3和MdOCP3-OE植株的離體葉片在25°C下的水分丟失。
- GL-3和MdOCP3-OE植株在干旱處理下的光合速率分析。
(l-n) 檢測GL-3和MdOCP3-OE植株在干旱處理下的過氧化氫酶(CAT)(l)、過氧化物酶(POD)(m)和丙二醛(MDA)(n)含量。
(o) 采用DAB染色檢測GL-3和MdOCP3-OE中的H2O2含量。
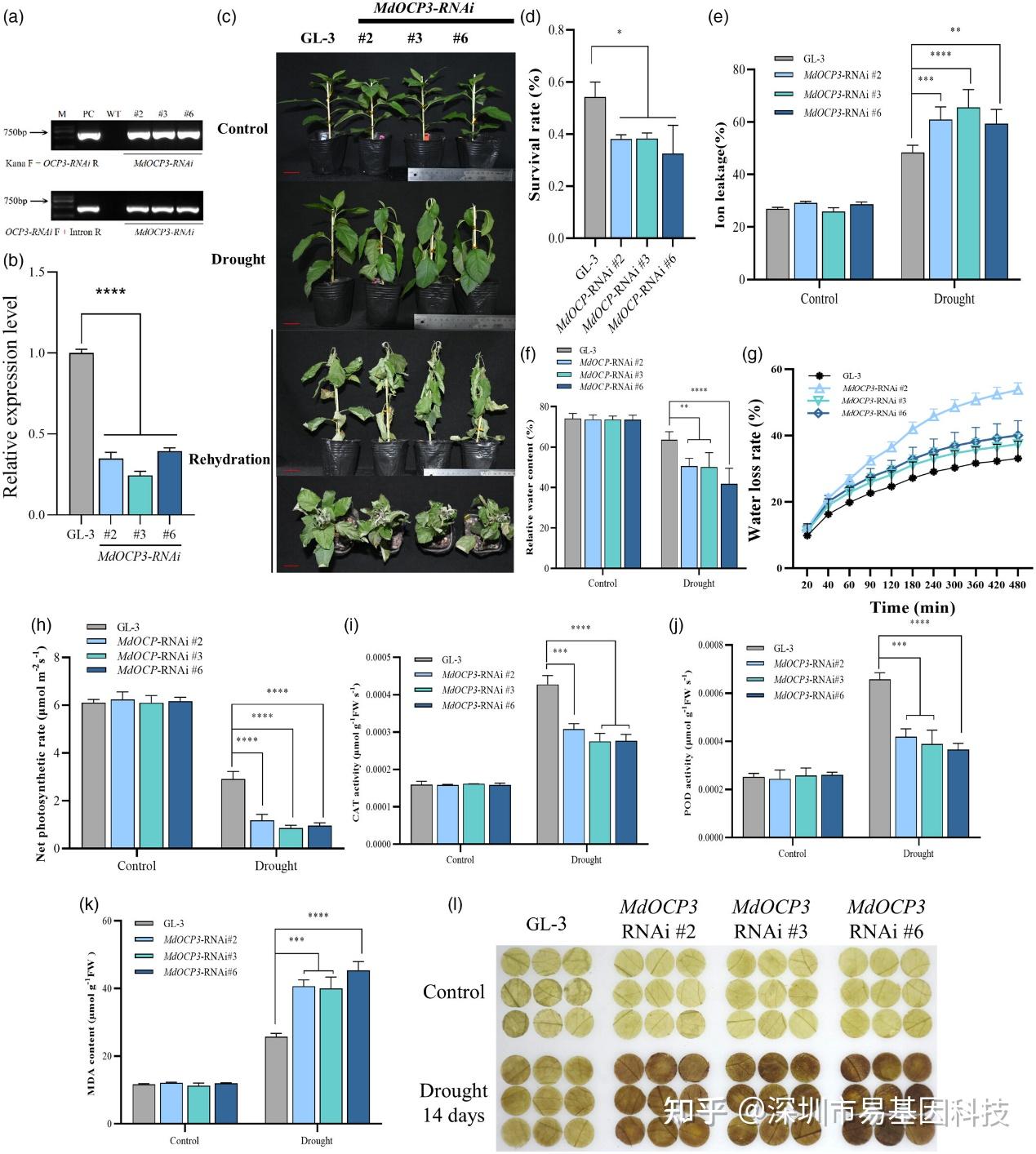
圖8:MdOCP3的RNA干擾((MdOCP3-RNAi))降低了蘋果的抗旱性。
- 在DNA水平上鑒定MdOCP3-RNAi轉基因株系。
- 在RNA水平上鑒定MdOCP3-RNAi株系。
- GL-3(野生型)和MdOCP3-RNAi轉基因植株的表型。
- 圖(c)中GL-3和三條獨立的MdOCP3-RNAi株系存活率。
- GL-3和MdOCP3-RNAi植株在干旱處理下的葉片離子滲漏測定。
- GL-3和MdOCP3-RNAi植株在干旱下的葉片相對含水量(RWC)。
- GL-3和MdOCP3-RNAi植株的離體葉片在25°C下的水分丟失。
- GL-3和MdOCP3-RNAi植株在干旱處理下的光合速率分析。
(i-k)檢測GL-3和MdOCP3-RNAi植株在干旱處理下的過氧化氫酶(CAT)(i)、過氧化物酶(POD)(j)和丙二醛(MDA)(k)含量。
(l) 采用DAB染色檢測GL-3和MdOCP3-RNAi中的H2O2含量。
(7)表觀遺傳修飾在干旱調控網絡中的作用
研究分析了表觀遺傳修飾在干旱響應網絡中的作用。通過注釋已知的干旱響應基因,研究發現許多基因受DNA甲基化和組蛋白修飾調控。例如,在ABA信號通路中,關鍵基因(如PYLs、PP2C、SnRKs和RAFs)受組蛋白修飾調控。與鈣離子通路和激酶級聯反應相關的基因(如CIPKs和CPKs)也受表觀遺傳修飾調控。這些結果表明,表觀遺傳修飾在蘋果干旱響應的信號和基因表達調控中發揮著重要作用。
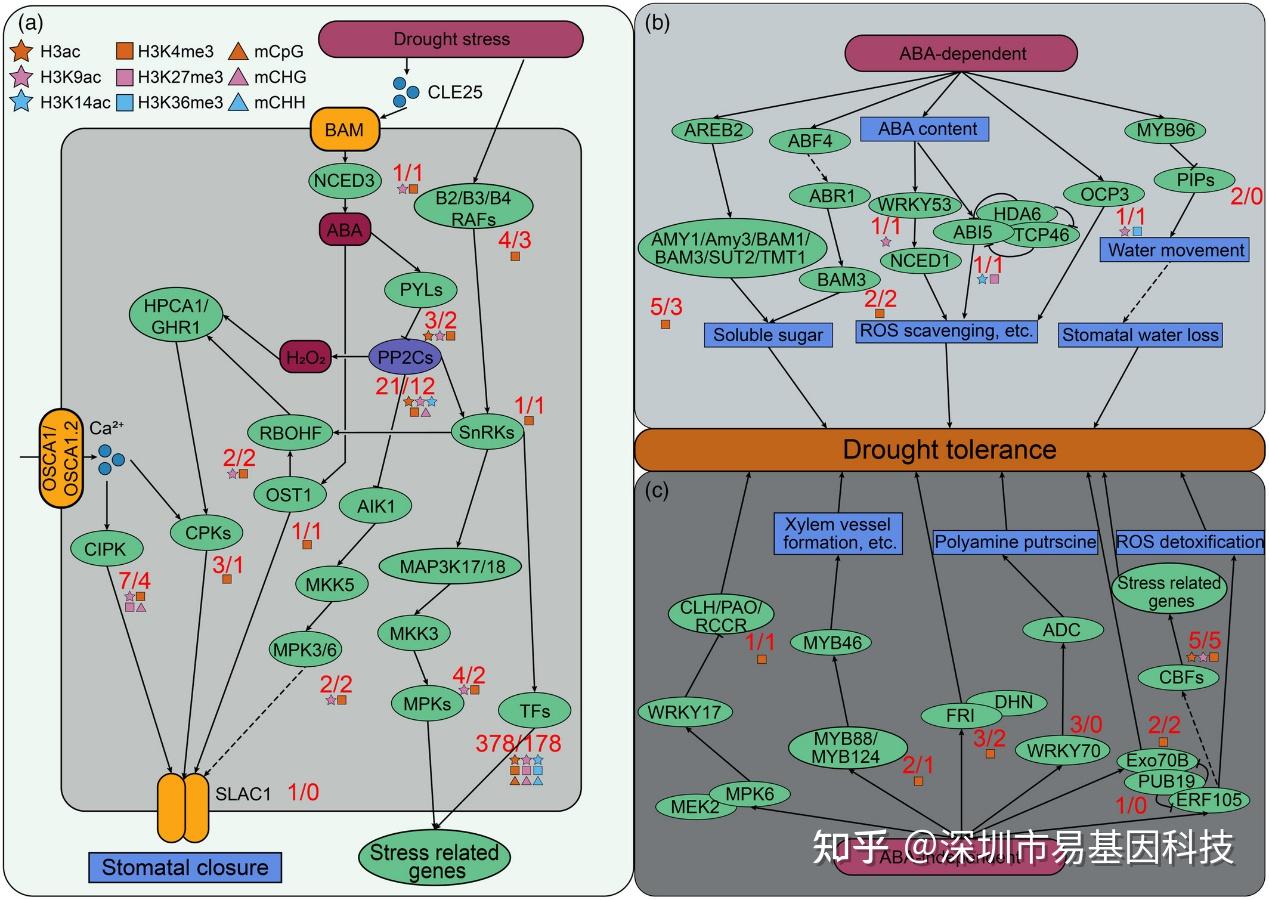
圖9:植物對干旱脅迫的感知、信號傳導以及ABA依賴和非依賴的轉錄調控網絡。
- 植物中與干旱脅迫感知和信號傳導相關的因子的表觀遺傳修飾注釋。TFs數量指在整個干旱過程中差異表達的所有轉錄因子(TFs)。
(b-c) 通過表觀遺傳修飾注釋的ABA依賴和ABA非依賴調控網絡。星形代表受組蛋白乙酰化修飾調控的DEGs,正方形代表受組蛋白甲基化修飾調控的DEGs,三角形代表受DNA甲基化修飾調控的DEGs。不同顏色代表不同類型的修飾。
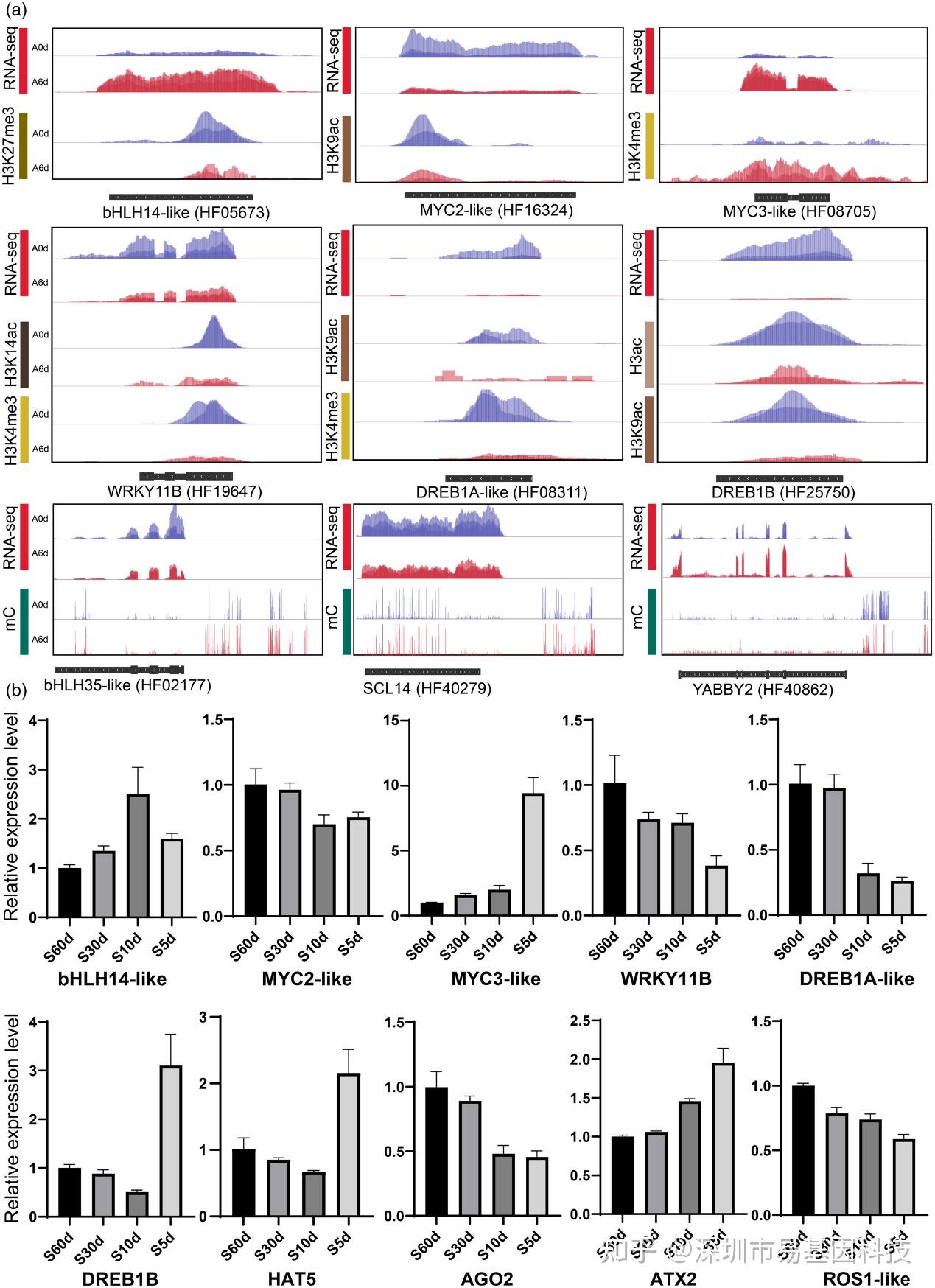
圖10:表觀遺傳因子及表觀遺傳調控基因的基因組快照和表達驗證。
- 基因組瀏覽器快照顯示6天干旱處理和對照中轉錄本水平與DNA甲基化和組蛋白修飾之間的關系。
- 在不同土壤含水量干旱處理下,受表觀遺傳修飾調控的基因和干旱響應的表觀遺傳因子的十個差異表達基因的RT-qPCR結果。
結論和啟示
本研究通過多組學分析揭示了蘋果在干旱脅迫下的表觀遺傳調控機制,特別是DNA甲基化和組蛋白修飾在基因表達調控中的作用。研究發現,DNA甲基化和組蛋白修飾在蘋果干旱響應中通過復雜的機制調控基因表達,且兩個關鍵基因MdABI5和MdOCP3通過組蛋白修飾正向調控蘋果的抗旱性。這些發現為理解植物抗旱的分子機制提供了新的視角,并為通過表觀遺傳修飾改良蘋果抗旱性提供了理論基礎。
WGBS、ChIP-seq和RNA-seq技術在本研究中發揮了重要作用,不僅揭示了全基因組水平的表觀遺傳變化,還為解析基因表達調控機制提供了有力工具。這些技術的綜合應用為未來類似植物抗逆研究提供了方法學參考。
關于易基因全基因組重亞硫酸鹽測序(WGBS)
全基因組重亞硫酸鹽甲基化測序(WGBS)可以在全基因組范圍內精確的檢測所有單個胞嘧啶堿基(C堿基)的甲基化水平,是DNA甲基化研究的金標準。WGBS能為基因組DNA甲基化時空特異性修飾的研究提供重要技術支持,能廣泛應用在個體發育、衰老和疾病等生命過程的機制研究中,也是各物種甲基化圖譜研究的首選方法。
易基因全基因組甲基化測序技術通過T4-DNA連接酶,在超聲波打斷基因組DNA片段的兩端連接接頭序列,連接產物通過重亞硫酸鹽處理將未甲基化修飾的胞嘧啶C轉變為尿嘧啶U,進而通過接頭序列介導的 PCR 技術將尿嘧啶U轉變為胸腺嘧啶T。
應用方向:
WGBS廣泛用于各種物種,要求全基因組掃描(不錯過關鍵位點)
- 全基因組甲基化圖譜課題
- 標志物篩選課題
- 小規模研究課題
技術優勢:
- 應用范圍廣:適用于所有參考基因組已知物種的甲基化研究;
- 全基因組覆蓋:最大限度地獲取完整的全基因組甲基化信息,精確繪制甲基化圖譜;
- 單堿基分辨率:可精確分析每一個C堿基的甲基化狀態。
關于易基因染色質免疫共沉淀測序 (ChIP-seq)
染色質免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究體內蛋白質與DNA相互作用的經典方法。將ChIP與高通量測序技術相結合的ChIP-Seq技術,可在全基因組范圍對特定蛋白的DNA結合位點進行高效而準確的篩選與鑒定,為研究的深入開展打下基礎。
DNA與蛋白質的相互作用與基因的轉錄、染色質的空間構型和構象密切相關。運用組蛋白特定修飾的特異性抗體或DNA結合蛋白或轉錄因子特異性抗體富集與其結合的DNA片段,并進行純化和文庫構建,然后進行高通量測序,通過將獲得的數據與參考基因組精確比對,研究人員可獲得全基因組范圍內某種修飾類型的特定組蛋白或轉錄因子與基因組DNA序列之間的關系,也可對多個樣品進行差異比較。
應用方向:
ChIP 用來在空間上和時間上不同蛋白沿基因或基因組定位
- 轉錄因子和輔因子結合作用
- 復制因子和 DNA 修復蛋白
- 組蛋白修飾和變異組蛋白
技術優勢:
- 物種范圍廣:細胞、動物組織、植物組織、細菌微生物多物種富集經驗;
- 微量建庫:只需5ng以上免疫沉淀后的DNA,即可展開測序分析;
- 方案靈活:根據不同的項目需求,選擇不同的組蛋白修飾特異性抗體。
參考文獻:
Wang S, He J, Hu B, Deng M, Li W, Guo J, Song Y, Zheng Q, Song X, Ma F, Wang J, Guan Q, Xu J. An integrative multi-omics analysis of histone modifications and DNA methylation reveals the epigenomic landscape in apple under drought stress. Plant Biotechnol J. 2025 Jul 7. doi: 10.1111/pbi.70173.
相關閱讀:
1、Nature | 易基因DNA甲基化測序助力人多能干細胞向胚胎全能8細胞的人工誘導
2、Cell|易基因微量DNA甲基化測序助力中國科學家成功構建胚胎干細胞嵌合體猴,登上《細胞》封面
3、項目文章|微量WGBS+ACE-seq揭示卵巢早衰的人卵丘細胞DNA甲基化與羥甲基化表觀基因組圖譜
4、項目文章|WGBS+RNA-seq揭示AtSAMS通過DNA甲基化和乙烯信號通路協同調控植物花器官發育的表觀遺傳機制
5、項目文章|ACS Nano/IF16:WGBS及多組學研究揭示納米塑料暴露對藻類初級生產力的長期作用及表觀調控機制
6、項目文章 | ChIP-seq等揭示糖皮質激素和TET2共調控促進癌癥轉移的表觀遺傳機制
7、項目文章 | Nat Commun:中南大學曾朝陽/熊煒/龔朝建團隊利用ChIP-seq等揭示頭頸鱗癌免疫逃逸機制
8、項目文章 | ChIP-seq等揭示糖皮質激素和TET2共調控促進癌癥轉移的表觀遺傳機制
9、項目文章:ChIP-seq等揭示人畜共患寄生蟲弓形蟲的蛋白質乳酸化和代謝調控機制
10、項目集錦 | 易基因近期染色質免疫共沉淀測序(ChIP-seq)研究成果
11、項目文章 | NAR:ChIP-seq等揭示蛋白質酰基化與c-di-GMP協同調控放線菌發育與抗生素合成機制
14、技術推介 | 染色質免疫共沉淀測序 (ChIP-seq)


 浙公網安備 33010602011771號
浙公網安備 33010602011771號